2025 年 12 月 4 日,国家药监局发布 2025 年第 43 号通告,曝光 29 家企业生产的 35 批次不符合规定药品,涉及化学药、中成药及中药饮片等多类品种。经 9 家药品检验机构检验,不合格项目包括溶出度、性状、不溶性微粒、农药残留量、微生物限度等,其中红参(红参片)不合格批次最多,达 11 批次,葛根 7 批次,小儿热速清糖浆 3 批次。
涉及企业涵盖四川通园制药、江苏万邦生化、山东华鲁制药等多家知名企业,不合格药品包括对乙酰氨基酚片、辅酶 Q10 注射液、碳酸氢钠注射液等常用药,以及赤芍、桑白皮等中药饮片。中药饮片性状不合格多与种属偏差、炮制瑕疵或储存不当相关,化学药则存在溶出度、pH 值等关键指标不达标问题。
目前,监管部门已要求相关企业暂停销售使用、召回问题药品,开展原因调查与整改。国家药监局明确要求省级监管部门依据《药品管理法》立案调查,严肃查处违法行为并公开结果,切实保障公众用药安全。

国家药监局关于35批次不符合规定药品的通告(2025年第43号)
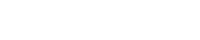
经广东省药品检验所等9家药品检验机构检验,共29家企业生产的35批次药品不符合规定。现将相关情况通告如下:
一、经广东省药品检验所检验,标示为四川省通园制药集团有限公司生产的1批次对乙酰氨基酚片不符合规定,不符合规定项目为溶出度。
二、经广东省药品检验所检验,标示为江苏万邦生化医药集团有限责任公司、湖北美林药业有限公司、马鞍山丰原制药有限公司生产的共4批次辅酶Q10注射液不符合规定,不符合规定项目涉及性状、不溶性微粒、可见异物。
三、经河北省药品医疗器械检验研究院检验,标示为圣嘉(滨海)生物医药科技有限公司委托山东光明药业有限公司生产的1批次普拉洛芬滴眼液不符合规定,不符合规定项目为有关物质。
四、经安徽省食品药品检验研究院检验,标示为山东华鲁制药有限公司、四川科伦药业股份有限公司生产的2批次碳酸氢钠注射液不符合规定,不符合规定项目涉及pH值、不溶性微粒、可见异物。
五、经陕西省食品药品检验研究院检验,标示为成都利尔药业有限公司生产的1批次转移因子胶囊不符合规定,不符合规定项目为活力测定。
六、经山东省食品药品检验研究院检验,标示为吉林省鑫辉药业有限公司生产的1批次木瓜丸不符合规定,不符合规定项目为微生物限度。
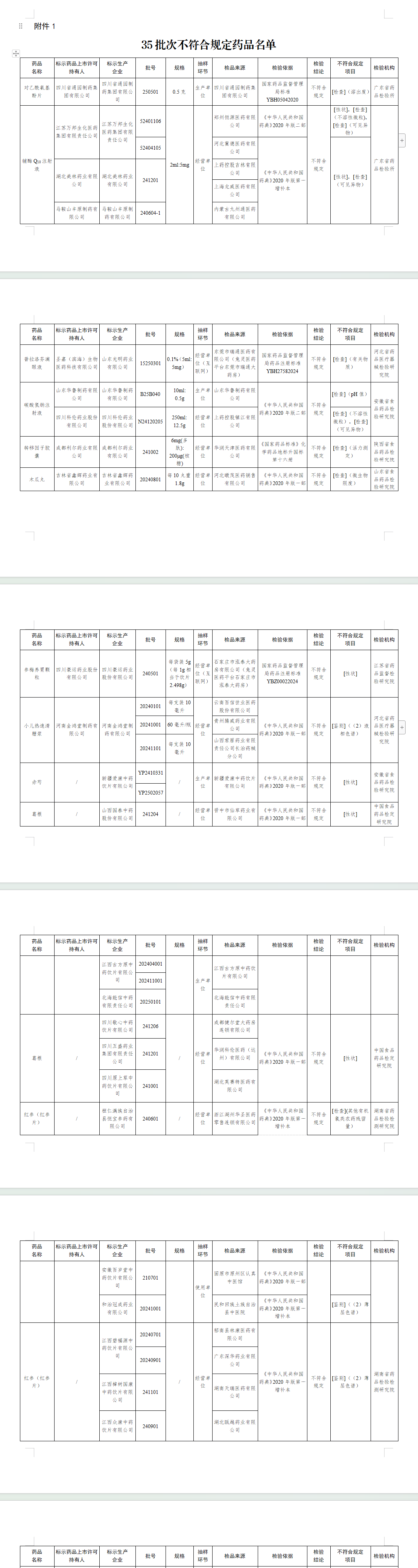
七、经江苏省药品监督检验研究院检验,标示为四川豪运药业股份有限公司生产的1批次参梅养胃颗粒不符合规定,不符合规定项目为性状。
八、经河北省药品医疗器械检验研究院检验,标示为河南金鸿堂制药有限公司生产的3批次小儿热速清糖浆不符合规定,不符合规定项目为鉴别。
九、经安徽省食品药品检验研究院检验,标示为新疆爱康中药饮片有限公司生产的2批次赤芍不符合规定,不符合规定项目为性状。
十、经中国食品药品检定研究院检验,标示为山西国泰中药股份有限公司、江西古方原中药饮片有限公司、北海能信中药有限责任公司、四川敬心中药饮片有限公司、四川五盛药业集团有限责任公司、四川原上草中药饮片有限公司生产的7批次葛根不符合规定,不符合规定项目为性状。
十一、经湖南省药品检验检测研究院检验,标示为桓仁满族自治县恒宝参药有限公司、安徽百岁堂中药饮片有限公司、和治冠成药业有限公司、江西碧福源中药饮片有限公司、江西樟树国康中药饮片有限公司、江西众康中药饮片有限公司、湖南省松龄堂中药饮片有限公司、湖南宜仁堂中药饮片有限责任公司、广东忠记药业股份有限公司、四川省卓宇制药有限公司生产的共11批次红参(红参片)不符合规定,不符合规定项目涉及其他有机氯类农药残留量、鉴别。
十二、经湖北省药品监督检验研究院检验,标示为成都市天晟中药材饮片有限责任公司生产的1批次桑白皮不符合规定,不符合规定项目为性状。
对上述不符合规定药品,药品监督管理部门已要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改。国家药监局要求相关省级药品监督管理部门依据《中华人民共和国药品管理法》,组织对上述企业和单位存在的涉嫌违法行为立案调查,并按规定公开查处结果。
特此通告。
国家药监局
2025年12月1日